PCSK9-remming veilig en effectief bij heterozygote en homozygote familiaire hypercholesterolaemie
Literatuur - Raal et al., the Lancet 2014Achtergrond
Patiënten met homozygote familiaire hypercholesterolaemie (HoFH) laten zeer lage plasma LDL-klaring zien, aanzienlijk verhoogde LDL-c niveaus en vroege cardiovasculaire morbiditeit en mortaliteit. HoFH is het gevolg van mutaties in ofwel LDL-receptorallelen (meer dan 95% van de patiënten), of de allelen van apolipoproteïne B, of PCSK9 of het LDL-receptor adaptor proteïne [1,2].Heterozygote FH (HeFH) kan het gevolg zijn van mutaties in dezelfde genen, hoewel in tot wel 20% van de patiënten met een klinische diagnose geen mutatie kan worden geïdentificeerd [3]. heFH wordt geschat één op de 250 tot 300 mensen wereldwijd te treffen [4,5]. Residuele LDL-receptor activiteit is geassocieerd met de ernst van de LDL-c stijging en de neiging om vroeg CV aandoeningen te ontwikkelen [6,7].
Conventionele behandeling met statines en ezetimibe kan LDL-c niveaus verlagen met gemiddeld ongeveer 40-50% [8-10]. Ondanks de recente goedkeuring van mipomersen (remt apolipoproteïne B synthese) door de FDA en de EMA en van lomitapide (remt microsomaal triglyceride transfer proteïne) door de EMA voor de behandeling van HoFH, blijven LDL-c niveaus erg hoog in bijna alle patiënten met HoFH, net als bij patiënten met HeFH.
Evolocumab is een volledig humaan monoklonaal antilichaam dat bindt aan PCSK9, dat de LDL-receptor markeert voor degradatie. Evolocumab maakt verhoogd hergebruik van de LDL-receptor mogelijk en verlaagt zo LDL-c niveaus met zo’n 60% bij patiënten met HeFH [11].
De Trial Evaluating PCSK9 Antibody in Subjects with LDL Receptor Abnormalities (TESLA) part B studie was een gerandomiseerde, dubbelblinde, placebogecontrolleerde fase 3 trial die de effectiviteit en veiligheid van evolocumab testte in patiënten met HoFH. RUTHERFORD-2 was een multicenter, gerandomiseerde, dubbelblinde, placebogecontrolleerde studie die de veiligheid en effectiviteit van evolocumag tweewekelijks of maandelijks toegediend onderzocht in een groot en gevarieerd cohort van patiënten met HeFH en met LDL-c>2.6 mmol/L ondanks intensieve lipideverlagende behandeling. TESLA en RUTHERFORD-2 werden tegelijk in The Lancet gepubliceerd.
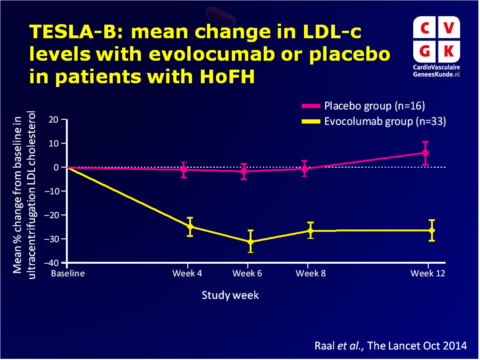
Belangrijkste resultaten TESLA part B
- Least-squares mean procentuele daling van LDL-c vanaf baseline na 12 weken behandeling met evolocumab was 23.1% (95%CI: -30.7 to -15.4), hetgeen 30.9% lager was (95%CI: -43.9 tot -18.0) dan met placebo (adjusted P<0.0001). Mean least-squares absolute daling met evolocumab vs. placebo was 2.4 mol/L (95%CI: -3.7 to -1.1).
- In de 7 adolescente patiënten (<18 jaar) die evolocumab kregen, was de least-squares mean daling van LDL-c vanaf baseline in week 12 26.0% (95%CI: -49.9 to -2.2).
- Afhankelijk van hoeveel LDL-c receptorallelen dysfunctioneel waren, werd een verschillende respons op behandeling gezien.
- Zelfs onder genetisch bevestigde HoFH patiënten met dezelfde LDL-receptor-mutaties werden variabele responsen op evolocumab gezien.
- Behandeling met evolocumab deed apolipoproteïne B niveaus ook significant dalen in week 12 ten opzichte van placebo, maar niet lipoproteïne (a) niveaus.
- Er werden geen ernstige bijwerkingen gerapporteerd, en behandelinggeïnduceerde bijwerkingen traden vaker op in de placebo (62%) groep dan in de evolocumab (36%) groep.
Download Raal Lancet TESLA 2014 cvgk.pptx
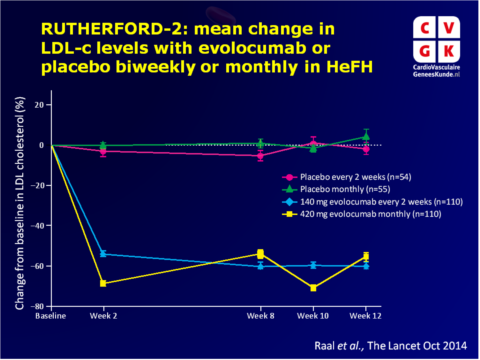
Belangrijkste resultaten RUTHERFORD-2
- Ten opzichte van placebo gaf tweewekelijkse evolocumab 140 mg gemiddelde LDL-c dalingen van 59.2% (95%CI: 53.4-65.1) in week 12. Maandelijkse toediening van evolocumab 420 mg resulteerde in gemiddelde dalingen in week 12 van 61.3% (95%CI: 53.6-69.0) vs. placebo.
- In week 12 werd LDL-c<1.8 mmol/L bereikt door 71 van de 104 (68%) patiënten op evolocumab 140 mg Q2W en door 65 van de 103 (63%) patiënten op evolocumab 420 mg maandelijks, ten opzichte van één patiënt in iedere placebogroep.
- Gemiddelde dalingen van lipoproteïne (a) en apolipoproteïne B in week 12 waren significant grotere in beide evolocumabgropen ten opzichte van de placebogroepen. Triglycerideniveaus waren ook significant lager met evolocumab, maar in sterkere mate met tweewekelijks 140 mg. HDL-c was significant toegenomen met evolocumab ten opzichte van placebo.
- LDL-c daling was vergelijkbaar tussen patiënten met receptor-negatieve of receptor-dysfunctionele activiteit, of in patiënten met ongeclassificeerde LDL-receptorstatus. Ook patiënten die genetisch homozygoot of compound heterozygoot waren, lieten vergelijkbaar grote dalingen zien met evolocumab.
- Vergelijkbare frequenties van bijwerkingen werden gemeld in de evolocumab en placebogroepen, en geen enkele ernstige complicatie leidde tot stoppen met de studiedrug, noch werd geoordeeld dat deze gerelateerd was aan het onderzochte middel.
Download Raal Lancet Rutherford 2014 cvgk.pptx
Conclusies
The TESLA part B studie bevestigt data van de pilotstudie dat PCSK9-remming met maandelijks subcutaane evolocumab 420 mg LDL-c verlaagt met 30.9% ten opzichte van placebo. Deze studie toont aan dat genetische informatie inzicht geeft in de mogelijke respons op behandeling van HoFH, en genetische bevesiting van HoFH kan worden gebruikt om patiënten te selecteren voor evolocumab-behandeling. In de meeste hoFH patiënten, met tenminste één dysfunctionele LDL-receptormutatie, LDL-c daling was 41%, dus veel patiënten in deze moeilijk te behandelen populatie lijken baat te hebben bij evolocumab.De RUTHERFORD-2 studie laat zien dat toevoeging van evolocumab-behandeling aan bestaande lipidenverlagende behandeling een LDL-c reductie van ongeveer 60% geeft, met een meerderheid van patiënten die LDL-c<1.8 mmol/L bereikt. Patiënten met receptor-negatieve mutaties reageerden even goed op behandeling als degene met dysfunctionele mutaties, hetgeen suggereert dat de respons op PCSK9-remming met evolocumab in HeFH met name afhangt van upregulatie van de niet-aangedane LDL-receptor, terwijl de mutante receptor een kleine rol speelt. Daarom is genetische analyse in patiënten met HeFH mogelijk niet zinnig voor bepaling van de respons op evolocumab.
De variabiliteit van de respons op evolocumab binnen patiëntengroepen met verschillende genetische eigenschappen zoals gezien in deze studies suggereert dat andere factoren dan de receptormutatie alleen ook een rol moeten spelen in de LDL-c daling met evolocumab.
Redactioneel commentaar [12]
“Ondanks de korte duur van deze studies, zijn hun bevindingen compatibel met langere termijn observaties in andere groepen patiënten met hypercholesterolaemie en ze bieden goede kwaliteit gegevens die de toekomstige zorg van familiaire hypercholesterolaemie verder zullen brengen. Moleculair testen, of inschatting van residuele LDL-receptorfunctie in fibroblasten is mogelijk nuttig om patiënten met HoFH te identificeren die waarschijnlijk op PCSK9-remmers zullen reageren. Deze benadering is echter niet van toepassing op patiënten met de heterozygote vorm van de aandoening. Wanneer wordt bewezen dat PCSK9 monoklonale antilichamen op de lange termijn veilig en effectief zijn, alsmede kosten-effectief, dan zijn deze mogelijk de beste standaard van zorg voor vele patiënten met ernstige vormen van familiaire hypercholesterolaemie.”Vind deze artikelen op Pubmed:
TESLA Part B. Raal et al., The Lancet Oct 1 2014
RUTHERFORD-2. Raal et al., The Lancet Oct 1 2014
Editorial comment. Santos RD and Watts GF. The Lancet Oct 1 2014
Referenties
1 Usifo E, Leigh SE, Whittall RA, et al. Low-density lipoprotein receptor gene familial hypercholesterolemia variant database: update and pathological assessment. Ann Hum Genet 2012; 76: 387–401.
2 Sjouke B, Kusters DM, Kindt I, et al. Homozygous autosomal dominant hypercholesterolaemia in the Netherlands: prevalence, genotype-phenotype relationship, and clinical outcome. Eur Heart J 2014; published online Feb 28. DOI:10.1093/eurheartj/ehu058
3 Vandrovcova J, Thomas ERA, Atanur SS, et al. The use of next-generation sequencing in clinical diagnosis of familial hypercholesterolemia. Genet Med 2013; 15: 948–57. 11 Neil A, Cooper J, Betteridge J, et al. Reductions in all
4 Goldstein JL, Hobbs HH, Brown MS. Familial hypercholesterolemia. In: Scriver CR, Beaudet AL, Sly WS, et al, eds. The metabolic and molecular bases of inherited disease, 8th edn. New York: McGraw Hill, 2001: 2863–913.
5 Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J 2013; 34: 3478–90a.
6 Cuchel M, Bruckert E, Ginsberg HN, et al. Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J 2014; published online July 22. DOI:10.1093/eurheartj/ehu274.
7 Raal FJ, Santos RD. Homozygous familial hypercholesterolemia: current perspectives on diagnosis and treatment. Atherosclerosis 2012; 223: 262–68.
8 Marais AD, Raal FJ, Stein EA, et al. A dose-titration and comparative study of rosuvastatin and atorvastatin in patients with homozygous familial hypercholesterolaemia. Atherosclerosis 2008; 197: 400–06.
9 Raal FJ, Pilcher GJ, Illingworth DR, et al. Expanded-dose simvastatin is effective in homozygous familial hypercholesterolaemia. Atherosclerosis 1997; 135: 249–56.
10 Gagne C, Gaudet D, Bruckert E, and the Ezetimibe Study group. Efficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation 2002; 105: 2469–75.
11 Raal F, Scott R, Somaratne R, et al. Low-density lipoprotein cholesterol-lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: the Reduction of LDL-C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) randomized trial. Circulation 2012; 126: 2408–17.
12. Santos RD, Watts GF. Familial hypercholesterolaemia: PCSK9 inhibitors are coming. The Lancet. October 2, 2014 http://dx.doi.org/10.1016/S0140-6736(14)61702-5

Deel deze pagina met collega's en vrienden: