De TICE-route scheidt actief cholesterol uit en kan worden beïnvloed door PCSK9 en statines
Literatuur - Le May C, Berger JM, Lespine A et al. - Arterioscler Thromb Vasc Biol. 2013 Jul;33(7):1484-1493
Transintestinal Cholesterol Excretion Is an Active Metabolic Process Modulated by PCSK9 and Statin Involving ABCB1.
Le May C, Berger JM, Lespine A et al.
Arterioscler Thromb Vasc Biol. 2013 Jul;33(7):1484-1493
Achtergrond
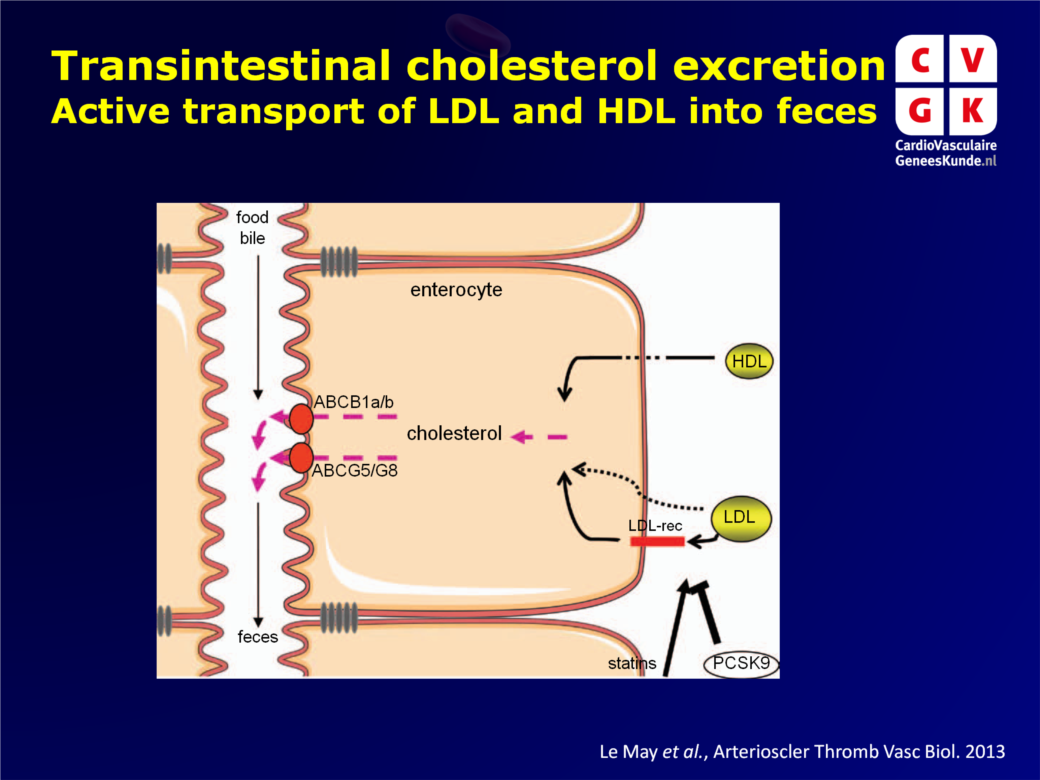
De hepatobiliaire route is lang als de belangrijkste cholesteroleliminiatieroute beschouwd. Er is nu ook een niet-biliaire route ontdekt die bijdraagt aan fecale steroluitscheiding bij honden, ratten en later mensen met een verstoorde biliaire excretie [1]. Transintestinale cholesterol excretie (TICE) wordt nu als belangrijk alternatief naast de hepatobiliaire route gezien [2]. Er zijn totnogtoe nog geen aanwijzingen gepubliceerd over TICE bij mensen. In muizen lijkt TICE wel 33% van de totale fecale steroluitscheiding voor zijn rekening te nemen [3]. Een mogelijk anti-atherogene rol voor TICE werd gesuggereerd door observaties in muizen dat TICE essentieel is voor macrofaag reverse cholesterol transport [4].De hepatische LDL-receptor (LDLR)[5] en de Scavenger receptor B1 [6] zijn belangrijk voor klassieke hepatobiliaire cholesterolklaring. LDLR komt ook in de darmen tot expressie. LDLR dichtheid hangt af van cholesterolniveaus, transcriptie-activatie door statines [5] en verhoogde LDLR degradatie door PCSK9 [7]. ATP-bindin cassette transporter B1 draagt bij aan de cholesteroldistributie [8].
Ondanks deze inzichten, is er nog veel onduidelijk over de precieze aard en de mechanismen van de TICE route. Gebruikmakend van transgene muizen (PCSK9+/- en LDLR-/-) en human weefsel, had deze studie tot doel een aantal van de resterende vragen te beantwoorden.
Belangrijkste resultaten
- Er werd een in vivo methode ontwikkeld die gebruik maakt van muizen duodenale explantaten, welke toonde dat LDL-transport een actieve metabole route is.
- Zowel HDL als LDL kunnen cholesterol leveren voor TICE, in vitro en in vivo in muizen.
- TICE werd ook gezien in humane jejunum explantaten.
- In PCSK9-deficiënten muizen was TICE via LDL verhoogd.
- Afbraak van LDLR door recombinant circulerend PCSK9 gaf verlaagd TICE.
- TICE werd geactiveerd door de cholesterol synthese-remmer Lovastatin.
- Bovenstaande resultaten suggereren dat LDLR een belangrijke rol speelt in TICE, en dat TICE mogelijk verlaagd is in LDLR-/- muizen. Verrassend genoeg lieten LDLR-/- muizen iets verhoogde (niet-significant maar reproduceerbaar) TICE zien dan wildtype muizen, mogelijk als gevolg van verhoogde LDL opname in de proximale darmen.
- Muizen deficiënt voor de multidrug transporter ABCB1a en -1b lieten minder fecale cholesterol excretie zien. Farmacologische remming van deze transporters gaf ook aanwijzingen dat ABCB1a/b bijdraagt aan TICE.
Conclusie
Deze studie draagt bij aan ons begrip ten aanzien van plasmacholesterolexcretie door de dunne darm. Het levert het eerste directe bewijs dat humane darmexplantaten LDL-C en HDL-C kunnen uitscheiden. LDL-TICE kan positief worden beïnvloed door statines en negatief door PCSK9. TICE en cholesterolemie lijken omgekeerd gerelateerd, hetgeen betekent dat TICE een actief proces is in plaats van een concentratie-afhankelijk proces.Redactioneel commentaar [9]
Het werk van Le May et al vertegenwoordigt een belangrijke vooruitgang van ons begrip van TICE.Hun data over HDL zijn onverwacht en staan in contrast met eerdere bevindingen. Verdere studies moeten deze kwestie oplossen.
De data suggereren een mogelijke betrokkenheid van LDLR op de basolaterale zijde, aangezien TICE onderdrukt kon worden door PCSK9 en geactiveerd door een statine. Dit vraagt om translationeel onderzoek, gebruikmakend van de momenteel onderzochte PCSK9-remmende behandelingen.
De ontdekte link tussen TICE en de LDL-route is veelbelovend. Gezien de huidige uitdagingen in het HDL veld, kan een nieuwe manier om specifiek de excretie van proatherogeen LDL-C uit het lichaam te stimuleren een grote impact hebben in de strijd tegen atherosclerotische hart- en vaatziekten.
Referenties
1. Deckelbaum RJ, Lees RS, Small DM, et al. Failure of complete bile diversion and oral bile acid therapy in the treatment of homozygous familial hypercholesterolemia. N Engl J Med. 1977;296:465–470.
2. van der Velde AE, Brufau G, Groen AK. Transintestinal cholesterol efflux. Curr Opin Lipidol. 2010;21:167–171.
3. van der Veen JN, van Dijk TH, Vrins CL, et al. Activation of the liver X receptor stimulates trans-intestinal excretion of plasma cholesterol. J Biol Chem. 2009;284:19211–19219.
4. Temel RE, Sawyer JK, Yu L, et al. Biliary sterol secretion is not required for macrophage reverse cholesterol transport. Cell Metab. 2010;12:96–102.
5. Goldstein JL, Brown MS. The LDL receptor. Arterioscler Thromb Vasc Biol. 2009;29:431–438.
6. Acton S, Rigotti A, Landschulz KT, et al. Identification of scavenger receptor SR-BI as a high density lipoprotein receptor. Science. 1996;271:518–520.
7. Rashid S, Curtis DE, Garuti R, et al. Decreased plasma cholesterol and hypersensitivity to statins in mice lacking Pcsk9. Proc Natl Acad Sci USA. 2005;102:5374–5379.
8. Grefhorst A, McNutt MC, Lagace TA, Horton JD. Plasma PCSK9 preferentially reduces liver LDL receptors in mice. J Lipid Res. 2008;49:1303–1311.
9. Tietge UJF, Groen AK. Role the DICE?: Advancing the concept of transinstinal cholesterol excretion. Arterioscler Thromb Vasc Biol. 2013;33:1452-1453

Deel deze pagina met collega's en vrienden: