Dabigatran en bloedingsrisico: nieuwe analyse FDA
Literatuur - Mary Ross Southworth, et al. - 10.1056/NEJMp1302834
Dabigatran and Postmarketing Reports of Bleeding
Mary Ross Southworth, Pharm.D., Marsha E. Reichman, Ph.D., and Ellis F. Unger, M.D.H
This article was published on March 13, 2013, at NEJM.org.
Hoewel de RE-LY studie geen significant verschil vond in bloedingsrisico tussen dabigatran en warfarine, post-marketing rapportages ontvangen via de FDA Adverse Event Reporting System (FAERS) wezen op de mogelijkheid dat dabigatran wellicht niet even veilig was in de klinische praktijk als het was in klinische trials.
Een mogelijke theorie is dat dabigatran anders of in andere patiëntenpopulaties is gebruikt dan in RE-LY Een review van de FAERS rapportages door de FDA vond echter geen aanwijzing dat dabigatran niet werd gebruikt in overeenstemming met de labelling.
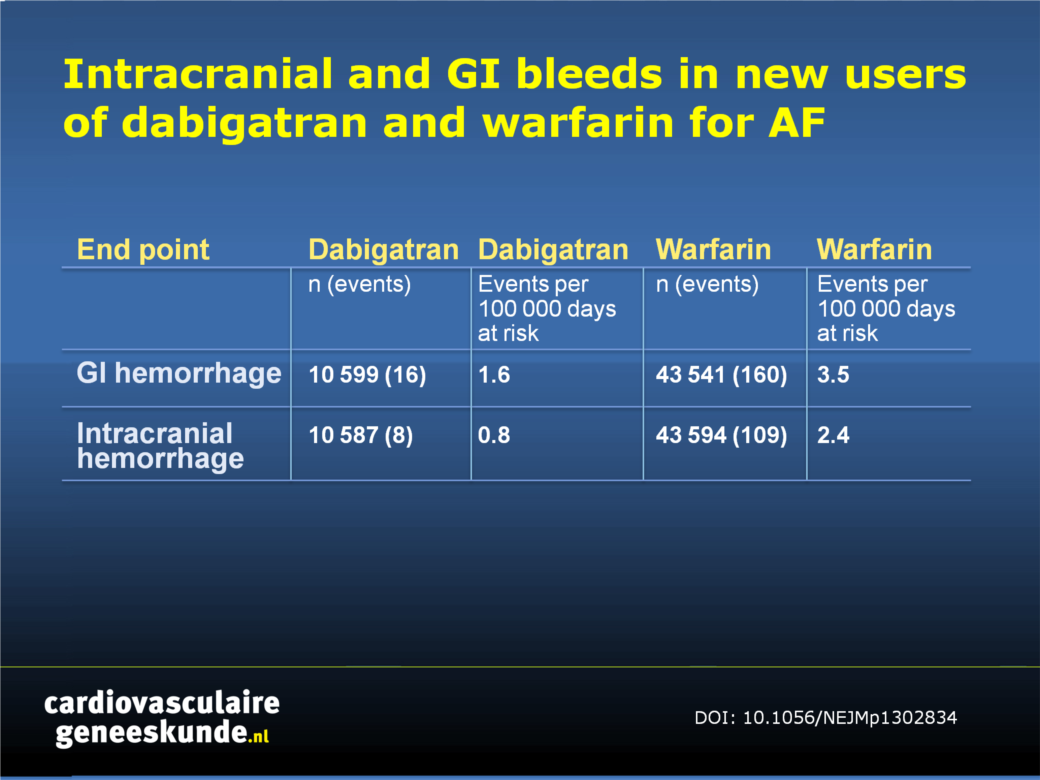
In de studie werd de Mini-Sentinel database geanalyseerd, waarin routinematig verzamelde elektronische gezondheidszorg data worden gemonitord, gedurende de periode van 19 oktober 2010 (de datum van dabigatran goedkeuring), tot 31 december 2011.
Het optreden van bloedingen geassocieerd met dabigatrangebruik tijdens die periode bleek niet hoger te zijn dan die in verband met warfarine.
Het grote aantal gemelde gevallen van bloedingen geassocieerd met dabigatran was waarschijnlijk een voorbeeld van gestimuleerde rapportage als gevolg van de publiciteit rond de lancering van het geneesmiddel en de neiging om bij voorkeur bijwerkingen te melden met nieuwe geneesmiddelen.
Nadere analyse van de Mini-Sentinel en andere databases is aan de gang, evenals routine postmarketing surveillance.

Deel deze pagina met collega's en vrienden: