Geïndividualiseerde duale antiplaatjestherapie in PCI patiënten kan vroege ischaemische events verminderen
Literatuur - Christ G et al., BMJ Open. 2014Individualising dual antiplatelet therapy after percutaneous coronary intervention: the IDEAL-PCI registry
Christ G, Siller-Matula JM, Francesconi M, et al.,
BMJ Open. 2014 Oct 31;4(10):e005781. doi: 10.1136/bmjopen-2014-005781
Achtergrond
Observationele studies hebben gesuggereerd dat hoge on-treatment plaatjesreactiviteit (HPR) op adenosine difosfaat (ADP) een sterke onafhankelijke risicofactor is voor ischaemische events in patiënten die duale antiplaatjestherapie (DAPT) krijgen na percutane coronaire interventie (PCI) [1-3].Het is totnogtoe echter onduidelijk en onderwerp van discussie of HPR een marker van hoog risico is of, een te beïnvloeden risicofactor [2]. Studies die gepersonaliseerde antiplaatjestherapie evalueerden om HPR te behandelen hebben tegenstrijdige resultaten opgeleverd, en methodologische beperkingen hebben mogelijk de waarde van deze strategie gemaskeerd [1,4].
HPR op acetylsalicylzuur (ASA) is minder goed bestudeerd. ADAPT-DES registerdata lieten geen verschil zien in reactie op ASA, zoals gemeten met de VerifyNow assay, tussen patiënten met en zonder ST [3]. Andere gegevens suggereren echter dat duale HPR op ADP-geïnduceerde en arachidonzuur-geïnduceerde (AA: reflecteert de respons op ASA) aggregatie patiënten gevoeliger maakt voor een hoger ischaemisch risico dan enkelvoudige HPR. Multiple electrode aggregometrie (MEA) kan effectief het risico op HPR op ADP na PCI bepalen [5].
Dit derdelijnszorg single centre register werd gebruikt om de impact te evalueren van geïndividualiseerde DAPT op geleide van MEA in een all-comers populatie, inclusief STEMI patiënten, door periprocedureel HPR op ADP en AA te behandelen. Uitkomsten werden vergeleken tussen een groep dat geen HPR had na clopidogrel laden (non-HPR) en de geïndividualiseerde groep (ADP receptorblokker-reloading en primaire prasugrel of ticagrelor laden, op basis van een logaritme).
Belangrijkste resultaten
- 30% van de clopidogrel-loaded patiënten lieten HPR zien.
- Na ASA en ADP receptorblokker-loading, liet 9% van de patiënten HPR zien in reatie op AA-geïnduceerde aggregatie. HPR op AA kwam significant vaker voor in patiënten met HPR op ADP (22% vs. 4%, P<0.001).
- HPR op AA zonder HPR op ADP (63+29 U) werd succesvol behandeld met ASA-reloading in alle patiënten (14+6 U, P<0.001).
- In patiënten met HPR op ADP beïnvloedde de mate van residuele AA-geïnduceerde plaatjes-aggregatie HPR op AA.
- ADP-geïnduceerde aggregatie na 600 mg clopidogrel loading was significant hoger in patiënten met HPR (=non-responder: 73+19 U) dan in patiënten zonder HPR (=responder: 28+11 U, P<0.001). Reloading behandelde HPR effectief (22+12 U, P<0.001), in alle behalve twee patiënten for wie prasugrel nog niet beschikbaar was.
ADP-geïnduceerde aggregatie na 60 mg prasugrel loading was significant hoger in patiënten met HPR (=non-responder: 82+26 U) dan zonder (=responder: 19+ U, P<0.001), en werd succesvol behandeld met ticagrelor reloading (35+15 U, P=0.002). - Glycoprotein IIbIIIa remmer (GPI) behandeling werd gegeven aan 61% (n=57) van de STEMI patiënten, en in 11% (n=47) van de NSTEMI patiënten.
- Er kwam geen acute ST voor binnen 24 uur, in het gehele patientcohort. Slechts een subabute definitieve ST trad op binnen 30 dagen (0.09%). Er werd geen stijging van het aantal bloedingen gezien in het geïndividualiseerde patiënten (2.6% TIMI major en minor bloedingen in beide groepen).
Download Christ BMJ 2014 cvgk.pptx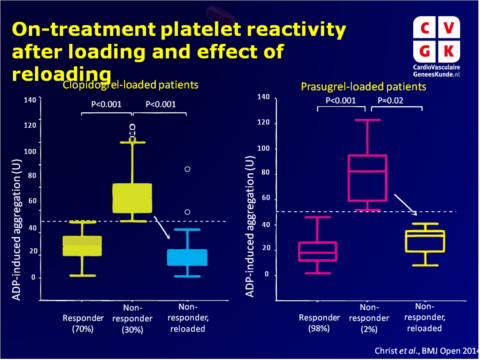
Conclusie
Deze studie levert real-world evidence dat routinematig efficiënte periprocedurele individualisering van DAPT met behulpt van MEA, en gebruik van nieuwe generatie ADP receptorblokkers vroege ischaemische events na PCI kan verminderen in een all-comers populatie, inclusief STEMI patiënten. Intensiveren van plaatjesremming in patiënten met HPR verhoogde het aantal bloedingscomplicaties niet, ten opzichte van patiënten zonder HPR onder DAPT. ADP-afhankelijke en ASA-afhankelijke plaatjesactivatie werken mogelijk synergistisch. Deze gegevens suggereren daarom dat HPR een te beïnvloeden risicofactor is waarop behandeling in PCI patiënten kan worden aangepast.Klik door naar dit artikel op Pubmed
Referenties
1. Tantry US, Bonello L, Aradi D, et al. Consensus and update on the definition of on-treatment platelet reactivity to ADP associated with ischemia and bleeding. J Am Coll Cardiol 2013;62:2261–73.
2. Aradi D, Storey RF, Komócsi A, et al.; on behalf of the Working Group on Thrombosis of the European Society of Cardiology. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J 2014;35:209–15.
3. Stone GW, Witzenbichler B, Weisz G, et al.; for the ADAPT-DES Investigators. Platelet reactivity and clinical outcomes after coronary artery implantation of drug-eluting stents (ADAPT-DES): a prospective multicentre registry study. Lancet 2013;382:614–23.
4. Siller-Matula JM, Jilma B. Why have studies of tailored anti-platelet therapy failed so far? Thromb Haemost. 2013;110:628–31.
5. Sibbing D, Braun S, Morath T, et al. Platelet reactivity after clopidogrel treatment assessed with point-of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol 2009;53:849–56.

Deel deze pagina met collega's en vrienden: