Interleukine-1 antagonisme in nieuwe type 1diabetes
Literatuur - Moran A, Bundy B, Becker DJ, et al; for the AIDA Study Group. - Lancet. 2013 Apr 4
Interleukin-1 antagonism in type 1 diabetes of recent onset: two multicentre, randomised, double-blind, placebo-controlled trials.
Moran A, Bundy B, Becker DJ, et al; for the AIDA Study Group.
Lancet. 2013 Apr 4. doi:pii: S0140-6736(13)60023-9. 10.1016/S0140-6736(13)60023-9. [Epub]
Achtergrond
Bij type 1 diabetes mellitus zijn interventies die achteruitgang van de β-cel functie stoppen of vertragen gewenst. [1,2] Recent onderzoek was gericht op de rol van het aangeboren afweersysteem bij type 1 diabetes. Vanwege het directe β-cel proapoptotische effect en mediërende effecten op glucotoxiciteit van β-cellen in de pancreas, is interleukine-1β betrokken bij de pathogenese van type 1 en type 2 diabetes. Naast de effecten in het aangeboren immuunsysteem kan interleukine-1β een rol spelen in de pathogenese van type 1 diabetes via krachtige versterking van de adaptieve immuunrespons. [3-5]Tot nu toe waren er geen gerandomiseerde, placebo-gecontroleerde studies van interleukine-1 antagonisme bij patiënten met recent ontstane type 1 diabetes. Daarom werd verondersteld dat interleukine-1β remming in nieuwe type 1 diabetes de β-cel functie zou kunnen behouden door het blokkeren van directe en hyperglykemie-gemedieerde β-cel toxiciteit, waardoor de totale inflammatie wordt verminderd en de ontwikkeling en functie van regulatoire T-lymfocyten wordt gestimuleerd. Om deze theorie te beoordelen, werd in twee studies getest of canakinumab, een humaan monoklonaal anti-interleukine-1 antilichaam of anakinra, een humane interleukine-1 receptor antagonist, de β-celfunctie handhaafde of verbeterde in nieuwe type 1 diabetes. Deze studies beoordeelden ook de haalbaarheid en de veiligheid en verdraagbaarheid van anti-interleukine-1 behandeling.
Twee gerandomiseerde, placebo-gecontroleerde studies werden uitgevoerd in twee groepen patiënten met recent ontstane type 1 diabetes en mixed-meal-tolerantie-test (MMTT)-gestimuleerde C-peptide van ten minste 0,2 nM.
De deelnemers werden gerandomiseerd naar subcutane injectie van ofwel 2 mg / kg (maximaal 300 mg) canakinumab of placebo per maand gedurende 12 maanden of 100 mg anakinra of placebo per dag gedurende 9 maanden. Het primaire eindpunt was de baseline-gecorrigeerde 2-h oppervlakte onder de curve van C-peptide respons op de mixed-meal tolerantietest na 12 maanden (canakinumab trial) en 9 maanden (anakinra trial).
Belangrijkste resultaten
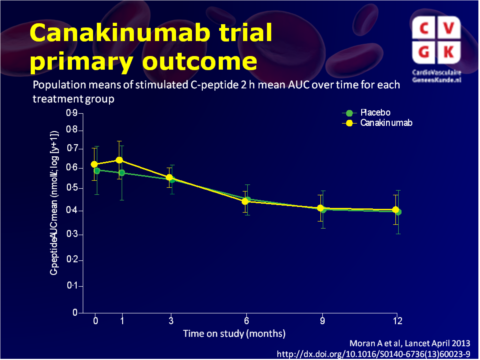
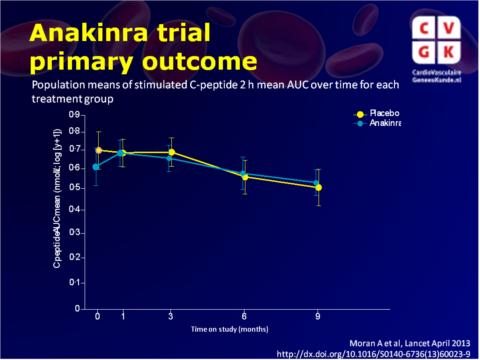
Het verschil in C peptide oppervlakte onder de curve tussen canakinumab en placebo groepen na 12 maanden was 0,01 nmol / L (95% CI -0,11 tot 0,14, p = 0,86) (fig. 1), en tussen de anakinra en de placebogroep na 9 maanden was 0,02 nmol / L (-0,09 tot 0,15, p = 0,71) (fig. 2).Het aantal en de ernst van de bijwerkingen verschilde niet tussen de groepen in de canakinumab studie. In de anakinra studie hadden patiënten in de anakinra groep significant hogere graden bijwerkingen dan de placebogroep (p = 0,018), wat voornamelijk kwam door een hoger aantal reacties op de injectieplaats in de anakinra groep.
Conclusie
Remming van interleukine-1β met ofwel canakinumab of anakinra vertraagde de reductie in β-cel functie in nieuwe type 1 diabetes niet. Interleukine-1β blokkade is wellicht meer geschikt voor combinatietherapie-protocollen in nieuwe type 1 diabetes of in preventiestudies in personen met pre-type 1 diabetes.Download CVGK.lancet moran 2013.pptx
Referenties
- The Diabetes Control and Complications Trial Research Group. Effect of intensive therapy on residual beta-cell function in patients with type 1 diabetes in the diabetes control and complications trial: a randomised, controlled trial. Ann Intern Med 1998; 128: 517–23.
- Steffes MW, Sibley S, Jackson M, Thomas W. Beta cell function and the development of diabetes-related complications in the diabetes control and complications trial. Diabetes Care 2003; 26: 832–36.
- Dinarello CA, Simon A, van der Meer JW. Treating inflammation by blocking interleukin-1 in a broad spectrum of diseases. Nat Rev Drug Discov 2012; 11: 633–52.
- Sanda S, Bollyky J, Standifer N, et al. Short-term IL-1beta blockade reduces monocyte CD11b integrin expression in an IL-8 dependent fashion in patients with type 1 diabetes. Clin Immunol 2010; 136: 170–73.
- Mandrup-Poulsen T, Pickersgill LMS, Donath MY. Blockade of interleukin 1 in type 1 diabetes mellitus. Nat Rev Endocrinol 2010; 6: 158–66.
Klik door naar de online versie van dit artikel

Deel deze pagina met collega's en vrienden: