Monoklonale antilichamen & PCSK9: therapeutische toepassingen voor HVZ
Literatuur - Catapano AL, Papadopoulos N. - Atherosclerosis. 2013 Feb 8. doi: 10.1016/j.atherosclerosis.2013.01.044.
The safety of therapeutic monoclonal antibodies: Implications for cardiovascular disease and targeting the PCSK9 pathway.
Catapano AL, Papadopoulos N.Atherosclerosis. 2013 Feb 8. doi: 10.1016/j.atherosclerosis.2013.01.044.
Hoewel goede resultaten ten aanzien van het verlagen van de incidentie van hart- en vaatziekten (HVZ) behaald kunnen worden door LDL-C niveaus te verlagen, lukt het bij een deel van de patiëntenpopulatie niet om LDL-C-streefwaarden te behalen. Bovendien verdraagt niet iedereen de doorgaans gebruikte statines. Dus, nieuwe behandelstrategieën zijn gewenst. Eén van de benaderingen die momenteel in ontwikkeling is, is het gebruik van monoklonale antilichamen (mAbs).
mAbs zijn inmiddels gevestigde therapieën voor een aantal aandoeningen, waaronder kanker en immunologische ziekten. Veel onderzoek is al gedaan naar de werkings- en distributiemechanismen, potentie, specificiteit, immunogeniteit en doseringsfrequentie.
Tot op heden is abciximab de enige mAb die geregistreerd is voor behandeling van een cardiovasculaire aandoening, namelijk na een dotterbehandeling en bij onstabiele angina. Een nieuw ontwikkelde klasse mAbs heeft PCSK9 (zie hieronder) als doelwit. Deze benadering heeft de potentie om het risico op hart- en vaatziekten binnen de perken te houden bij patiënten bij wie de gebruikelijke therapieën om LDL-C te verlagen niet werken.
We vatten hier de belangrijkste boodschappen uit het overzichtsartikel voor u samen.
Hoe werken mAbs?
mAbs kunnen direct een interactie aangaan met hun target en hierdoor de biologische functie van dit eiwit veranderen. Ook kunnen ze een interactie aan gaan met celoppervlaktereceptoren, hetgeen immuungemedieerde downstream effecten zoals cytotoxiciteit tot gevolg kan hebben. Bovendien kan het complementsysteem worden geactiveerd wanneer een mAbs aan zijn targeteiwit bindt, ook met cytotoxiciteit als resultaat.
Hoe worden mAbs gemaakt?
De eerste generatie therapeutische mAbs werd in muizen gemaakt. Patiënten die met immunoglobulinen van muizen werden behandeld, ontwikkelden vaak humane anti-muis antilichamen (HAMAs), wat leidde tot snelle klaring van de mAbs. Dit probleem werd opgelost door een murien antigeenbindend domein te fuseren met een humaan constant antilichaamdomein. Deze gehumaniseerde chimeer-antilichamen veroorzaakten minder HAMA-vorming, maar hadden ook minder bindingsaffiniteit. Recent zijn volledig humane mAbs geproduceerd, welke minder immunogeniteit veroorzaken dan muriene en chimere mAbs. Er zijn al negen volledig humane mAbs goedgekeurd voor therapeutisch gebruik in Europa en de Verenigde Staten.
Zorgen omtrent de veiligheid
De directe interactie met het doelmolekuul en/of- processen kan resulteren in bijwerkingen. Bijwerkingen kunnen optreden als gevolg van het beoogde farmacologische effect van de mAb, of de mAbs kunnen toxiciteit veroorzaken door een interactie aan te gaan met het targetantigeen buiten het doelorgaan. Bovendien kan off-target, niet-specifieke toxiciteit geobserveerd worden, zoals overgevoeligheidsreacties, waarvan gedacht wordt dat ze het gevolg zijn van immunogeniteit van de mAbs. Dit risico is grotendeels, maar nog niet geheel, opgelost door de ontwikkeling van volledig humane mAbs.Globaal gezien zijn de risico’s op ernstige bijwerkingen van mAbs betrekkelijk laag. mAbs worden doorgaans goed getolereerd door patiënten. Ook lijkt de veiligheid relatief stabiel te zijn in de tijd.
mAbs in de behandeling van hart- en vaatziekten
De eerste mAbs zijn ontwikkeld voor de behandeling van HVZ of de risicofactoren:- Abciximab: remt cross-linking en klontering van plaatjes door te binden aan glycoproteïne IIb/IIIa, dus het vermindert bloedstolling, voor gebruik in patiënten die een dotterbehandeling ondergaan. Het is een chimeer mAb, hetgeen waarschijnlijk de oorzaak is van de off-target, niet-specifieke bijwerkingen. Specifieke bijwerkingen worden ook gezien, zoals een verhoogd risico op bloeding en trombocytopenie.
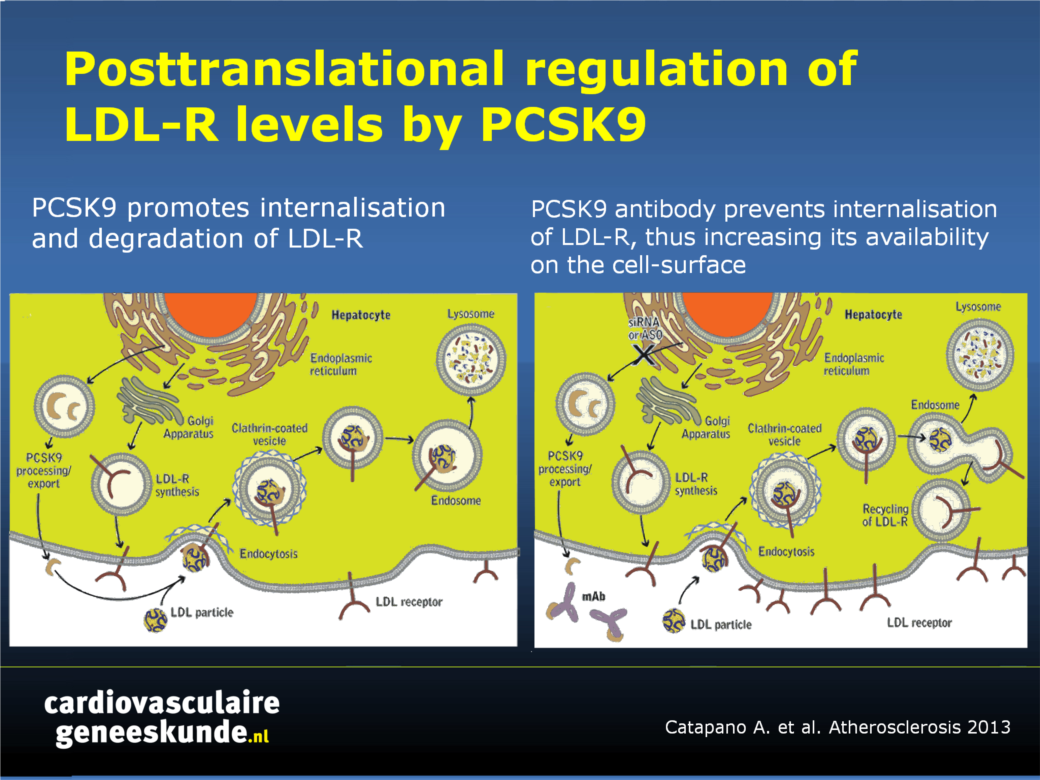
- PCSK9 mAbs: bindt aan proproteïne convertase subtilisine/kexine type 9 (PCSK9). Deze serine protease is verantwoordelijk voor post-transcriptionele regul atie van LDL-receptor (LDLR) niveaus. PCSK9 bindt normaalgesproken aan de LDLR en stimuleert de internalisatie en afbraak van LDLR. Verminderde beschikbaarheid van LDLR leidt to hoger plasma LDL-C. Het blokkeren van de interactie tussen PCSK9 en LDLR met behulp van mAbs zal dus waarschijnlijk het risico op HVZ verminderen in mensen met hypercholesterolemie. De verwachting is dat PCSK9 mAbs ook het lipidenverlagende effectiviteit van statines zal vergroten.
Effectiviteit en veiligheid van PCSK9 mAbs
Genetische variatie in het PCSK9 gen kan de affiniteit voor de LDLR beïnvloeden, en dus plasmacholesterolniveaus, met gevolgen voor het risico op HVZ. Zowel gain-of-function als loss-of-function PCSK9-mutaties zijn beschreven, resulterend in respectievelijk verhoogd en verlaagd risico op HVZ. Preklinische studies met diverse PCSK9 mAbs, ontwikkeld door verschillende farmaceutische bedrijven, hebben veelbelovende verlaging van serumcholesterol laten zien in meerdere diersoorten (knaagdieren, primaten).Fase I-studies in gezonde individuen of mensen met hypercholesterolemie hebben aangetoond dat PCSK9 mAbs doorgaans goed worden getolereerd en dat ze een statistisch significante reductie in LDL-C bewerkstellingen (details van de studies worden besproken in het artikel).
De eerste fase II klinische studies zijn recentelijk afgerond, waarin verschillende doseringsschema’s werden getest, alsmede combinatietherapieën met statines. Ook deze details worden besproken in het artikel.
Conclusie
Ondanks dat het gebruik van mAbs voor de behandeling van hypercholesterolemie nog in de kinderschoenen staat, laten de huidige data al zien dat volledig humane mAbs tegen PCSK9 een klinisch betekenisvolle LDL-C-verlaging geven in patiënten, onafhankelijk van statinebehandeling. Er zijn nog geen on-target-bijwerkingen als gevolg van het blokkeren van PCSK9 geïdentificeerd.Het moet in ogenschouw worden genomen dat deze conclusies gebaseerd zijn op kleinschalige studies en een beperkte blootstelling aan de nieuwe therapie. Er zijn al grotere, langer lopende studies aan de gang, die de langetermijneffectiviteit en –veiligheid moeten beoordelen, alsook het gebruik in een bredere patiëntengroep

Deel deze pagina met collega's en vrienden: